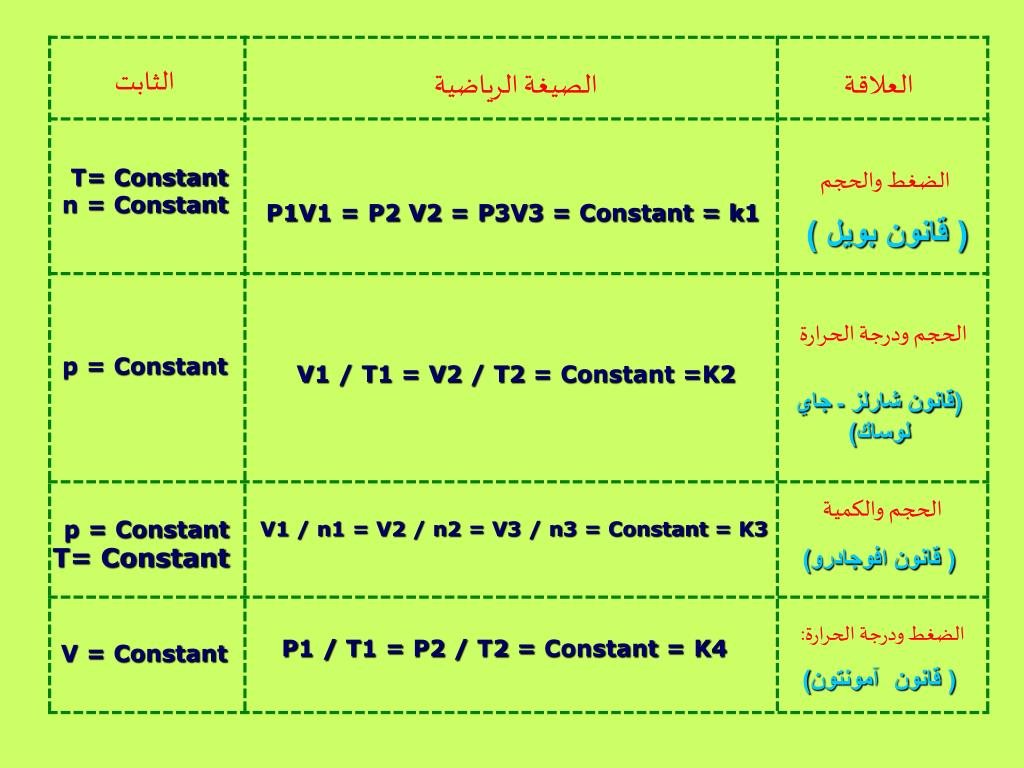
( قانون شارلز )
قانون شارلز

يُعرف قانون شارلز أيضًا بقانون الحجم، وهو قانون غازي يُنسب إلى العالم الفرنسي جاك ألكسندر شارلز، والذي ينص على أن حجم غاز ما يتناسب طرديًا مع درجة حرارته المطلقة عند مستوى ثابت من الضغط.

العلاقة الرياضية
يمكن التعبير عن قانون شارلز رياضيًا على النحو التالي:
V/T = ثابت

حيث:
- V: حجم الغاز
- T: درجة الحرارة المطلقة للغاز
التطبيقات
لقانون شارلز مجموعة واسعة من التطبيقات في مجالات مختلفة، منها:
1. مراقبة الطقس
يستخدم قانون شارلز في أجهزة قياس الحرارة لقياس درجة الحرارة من خلال مراقبة تغييرات الحجم في غاز محجوز.
2. التحكم في التفاعلات الكيميائية
يُؤثر قانون شارلز على معدل التفاعلات الكيميائية، حيث تميل التفاعلات إلى الحدوث بشكل أسرع عند درجات حرارة أعلى بسبب زيادة حجم الغازات المتفاعلة.
3. تصميم المحركات
يعتمد عمل المحركات الاحتراقية على قانون شارلز، حيث يزداد حجم الغازات داخل الأسطوانات عند ارتفاع درجة الحرارة، مما يؤدي إلى توليد الطاقة.
الاستثناءات والقيود
بينما يكون قانون شارلز دقيقًا بشكل عام للغازات المثالية، إلا أن هناك بعض الاستثناءات والقيود:

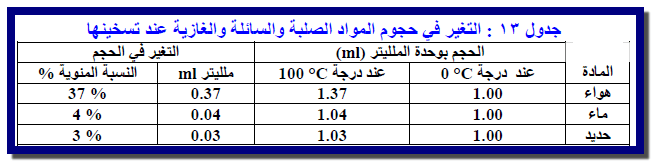
1. الغازات الحقيقية
تتبع الغازات الحقيقية قانون شارلز فقط عند درجات حرارة وضغوط منخفضة، حيث يمكن تجاهل الانحرافات عن السلوك المثالي.
2. درجات الحرارة المنخفضة جدًا
عند درجات حرارة منخفضة جدًا، يمكن أن تنحرف الغازات عن قانون شارلز بسبب حدوث التكثيف أو التحولات الطورية الأخرى.
3. الضغوط العالية جدًا
عند الضغوط العالية جدًا، تزدحم جزيئات الغاز وتتفاعل مع بعضها البعض، مما يؤدي إلى انحرافات عن السلوك المثالي.

الاستنتاج
يُعد قانون شارلز أحد القوانين الغازية الأساسية التي تصف العلاقة بين حجم الغاز ودرجة حرارته. ويستخدم على نطاق واسع في مجموعة متنوعة من التطبيقات، بما في ذلك مراقبة الطقس والتحكم في التفاعلات الكيميائية وتصميم المحركات.